Científicos han logrado modificar genéticamente bacterias para producir proteínas reales de vaca, como la caseína, fundamental en la elaboración de lácteos. Este avance biotecnológico abre la puerta a productos como queso o leche sin necesidad del uso de animales, pero con la misma funcionalidad y valor nutricional, ofreciendo una alternativa para quienes buscan productos sin el uso de animales en su proceso.
Phys / 20 de julio, 2025.- Las bacterias están llamadas a transformar el futuro de los productos lácteos «sin lácteos». Científicos han modificado con éxito la bacteria E. coli para producir proteínas lácteas esenciales para la producción de queso y yogur, sin utilizar ingredientes de origen animal. Esto abre el camino a alternativas lácteas de origen vegetal que imitan los lácteos tradicionales a nivel molecular, pero son sostenibles y libres de uso animal.
Un estudio reciente publicado en Trends in Biotechnology informó dos métodos para producir caseína (una proteína de la leche) que son nutricional y funcionalmente similares a la caseína bovina.
[Recomendado: Desarrollan plantas modificadas genéticamente que producen nutrientes esenciales de la leche materna]
La caseína es un componente muy solicitado en las dietas de bebés y adultos, ya que es digerible, de alta calidad y aporta varios aminoácidos esenciales que nuestro cuerpo necesita. El mercado mundial de caseína, valorado en 2700 millones de dólares estadounidenses en 2023, se produce a costa del manejo animal y un alto impacto ambiental. Este aumento en la demanda de opciones sostenibles y sin lácteos ha llevado a los investigadores a buscar métodos alternativos para producir caseína.
Las industrias alimentaria y farmacéutica llevan tiempo utilizando microorganismos como fábricas celulares para la producción a gran escala de biomoléculas, suplementos dietéticos y enzimas. Los científicos sentían curiosidad por ver si este mismo enfoque podía aplicarse a las proteínas de caseína recombinante, producidas mediante ingeniería genética en fábricas celulares microbianas. Sin embargo, estas técnicas a menudo no replican un factor clave que confiere a la caseína sus propiedades únicas: la fosforilación, un proceso biológico en el que se añade un grupo fosfato a una proteína.
[Recomendado: Startup recibe el primer permiso regulatorio de Israel para vender leche de laboratorio «molecularmente idéntica» a la de vaca]
La fosforilación de los residuos de serina (componentes aminoácidos) es fundamental para la capacidad de la caseína de unirse al calcio, lo que estabiliza la leche y le proporciona propiedades nutricionales. La unión del calcio también garantiza la formación de estructuras proteicas a nanoescala llamadas micelas de caseína, que actúan como agentes transportadores de calcio y fosfato biodisponibles.
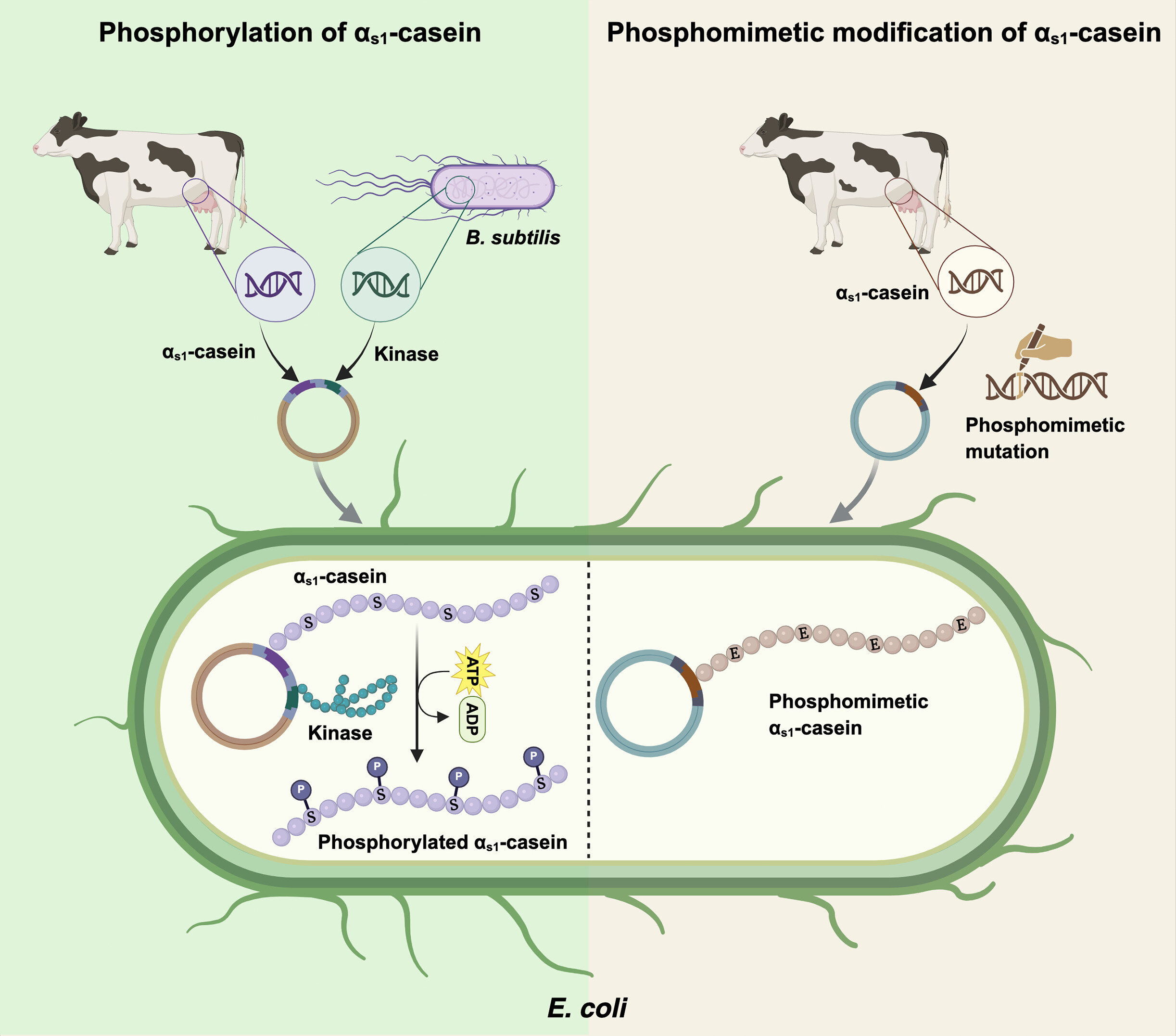
Para superar este problema, los investigadores adoptaron dos estrategias principales. En primer lugar, modificaron bacterias para que coexpresaran tres proteína quinasas de Bacillus subtilis, enzimas que catalizan la adición de grupos fosfato a las proteínas. En segundo lugar, diseñaron una versión fosfomimética de la αs1-caseína, en la que los residuos de serina normalmente fosforilados en la proteína natural se reemplazaron con ácido aspártico para imitar la carga negativa y los efectos funcionales de la fosforilación.
[Recomendado: Apto para veganos: Crean helado con levaduras transgénicas que producen proteína de la leche]
El equipo realizó análisis estructurales, pruebas de unión al calcio y una digestión gastrointestinal simulada de la αs1-caseína derivada. Los resultados indicaron que tanto la caseína fosforilada como la fosfomimética de origen bacteriano presentaban una alta capacidad de unión al calcio, y su digestibilidad y estructura eran comparables a las de la caseína de origen bovino.
Los investigadores destacaron que, si bien la fosforilación mediada por quinasas proporciona una vía para imitar estrechamente la caseína nativa, la caseína fosfomimética proporciona una vía más sencilla para producir proteínas funcionalmente similares. También sugirieron que se requieren más análisis cuantitativos para aprovechar al máximo nuestra capacidad de aprovechar la producción microbiana de caseínas para aplicaciones lácteas y alimentarias sostenibles y libres de manejo animal.

