Un investigador de la Universidad Estatal de Carolina del Norte ha desarrollado una nueva forma de utiliza edición genética con CRISPR/Cas9 en las células vegetales sin insertar ADN externo. Esto permite supresiones o reemplazos genéticos precisos, sin insertar ADN foráneo. Por lo tanto, el producto final no es un «organismo genéticamente modificado» (OGM) o transgénico.
Universidad Estatal de Carolina del Norte / 11 de mayo de 2020.- CRISPR/Cas9 es una herramienta que se puede utilizar para cortar con precisión y eliminar o reemplazar una secuencia genética específica. La proteína Cas9 sirve como un par de tijeras moleculares, guiadas al objetivo genético específico por una guía de ARN fácilmente intercambiable. Básicamente, busca una secuencia genética específica y, cuando encuentra esa secuencia, la corta. Una vez que se corta la secuencia de ADN objetivo, se puede eliminar o reemplazar.
El sistema CRISPR/Cas9 tiene un enorme potencial para mejorar los cultivos al cambiar su código genético. Eso no significa necesariamente insertar ADN foráneo, pero los sistemas utilizados para administrar CRISPR/Cas9 en las células de una planta a menudo sí lo hacen, lo que significa que el cultivo relevante es un OGM. Los OGMs (o transgénicos) se someten a un riguroso proceso de evaluación y muchos consumidores prefieren productos libre de OGMs.
El Departamento de Agricultura de los Estados Unidos (USDA) y la Administración de Alimentos y Medicamentos (FDA) del mismo país, regulan los cultivos genéticamente modificados y tienen estándares que definen qué son los cultivos transgénicos. Estos se centran en la presencia de secuencias de ADN de otras especies que están presentes en el producto final.
Eliminar o rechazar un gen, como el responsable de oxidar o pardear una rodaja cortada de manzana, no introduce ADN externo y, por lo tanto, es un método que no se clasifica como OGM. De manera similar, alterar la expresión de un gen relacionado con la resistencia a las plagas en una variedad de camote para hacerlo más resistente, podría ser un método libre de OGMs.
[Recomendado: CRISPR: La herramienta de edición genética que está revolucionando la medicina y agricultura]En un nuevo estudio publicado en la revista Plant Cell Reports, Wusheng Liu, biólogo de plantas y biotecnólogo del Departamento de Ciencias Hortícolas, demostró una nueva forma de introducir la proteína Cas9 y guiar el ARN en las células vegetales, sin involucra ADN exógeno.
«Esta fue la primera vez que alguien ideó un método para administrar la proteína Cas9 a través de la lipofección en las células vegetales», dijo Liu. «Nuestro mayor logro fue hacer que eso suceda. Además, dado que muchos consumidores prefieren cultivos especializados que no son OGMs, este método entrega la proteína Cas9 de una manera no-OGM».
La lipofección es un método que utiliza lípidos cargados positivamente, algo así como los que se encuentran en el detergente lavaplatos, para formar un liposoma con forma de burbuja que rodea el complejo Cas9/gRNA. El liposoma se une y luego se fusiona con la membrana celular de la planta, introduciendo su carga CRISPR en la célula de la planta. Se ha utilizado con éxito para administrar el complejo proteico CRISPR/Cas9 en células de mamíferos.
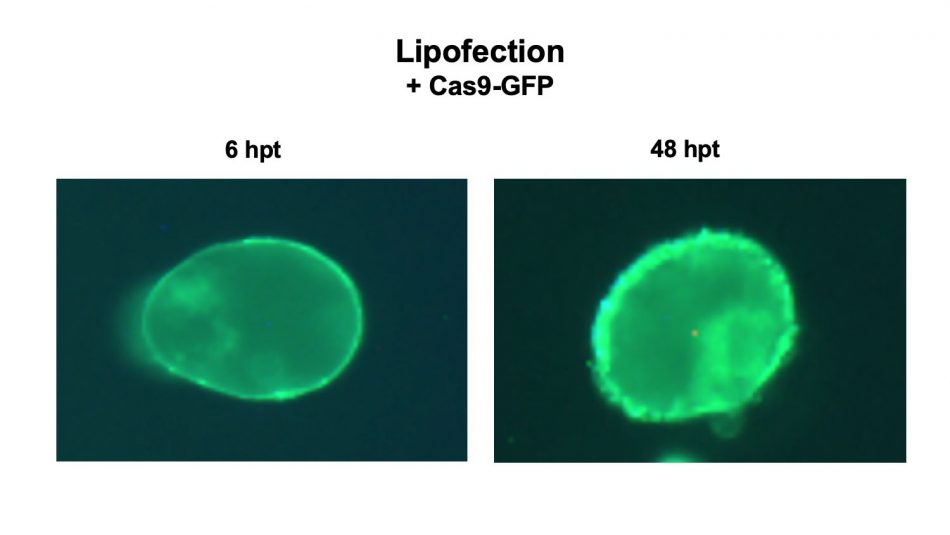
«Muchos programas en todo el mundo se centran en la entrega de ADN CRISPR/Cas9», dijo Liu. «Solo hay una cantidad muy limitada de investigación centrada en la entrega de proteínas Cas9. Pero la entrega de proteínas tiene muchas ventajas».
En primer lugar, al administrar la proteína Cas9 en lugar de la secuencia de ADN de Cas9, no hay transferencia de secuencias de ADN específicas de una especie a otra. La proteína Cas9 dura de tres a cinco días y luego se degrada. Esto reduce el corte en lugares no deseados, conocido como escisión o corte fuera del objetivo, dijo Liu.
Además, el método más común para introducir ADN en las plantas se llama transformación mediada por Agrobacterium. Agrobacterium es un grupo de bacterias que causan enfermedades de las plantas. Los científicos no pueden controlar dónde se agrega el nuevo ADN al genoma de la planta con este método, dijo Liu. Además, este método no funciona para muchas variedades de cultivos de élite que son muy difíciles de transformar. Además, dado que el proceso introduce ADN exógeno, el producto final es un OGM (transgénico).
Por otro lado, el proceso de introducir CRISPR/Cas9 en un liposoma requiere que se elimine la pared externa resistente de la célula vegetal. Las células vegetales sin la pared celular se llaman protoplastos. La conversión de este protoplasto en un brote, y luego en una planta completa, requiere una cuidadosa combinación de hormonas y nutrientes vegetales. Se han desarrollado métodos para regenerar plantas a partir de protoplastos para más de 50 tipos de cultivos, incluidos trigo, tomates, fresas y tabaco, dijo Liu. Sin embargo, los métodos no se han resuelto para cada cultivo.
Liu también está trabajando en algunos otros métodos para introducir la proteína Cas9 en las células vegetales que no requieren la eliminación de la pared celular.
Uno de estos métodos utiliza nanopartículas para introducir la proteína Cas9 en los granos de polen. Luego, cuando el polen se usa para fertilizar una flor femenina, el tubo de polen introducirá Cas9 en el óvulo junto con el esperma. Algún porcentaje de la semilla resultante tendrá las ediciones genéticas deseadas producidas por el complejo CRISPR/Cas9. Le gustaría usar este método para introducir primero la proteína Cas9 en el tomate y el cáñamo, y finalmente adaptarlos a otros cultivos reproducidos sexualmente, afirmó.
[Recomendado: Nuevo sistema de edición genética con polen transportador de CRISPR]La innovación de Liu no ha pasado desapercibida para sus colegas. Tom Ranney y Craig Yencho, profesores del Departamento de Ciencias Hortícolas, se encuentran entre los que están colaborando con Liu para aplicar estos métodos no-GM para promover características beneficiosas en cultivos de vivero y camote, respectivamente.
«El desarrollo de estos sistemas para otros cultivos especializados, incluidos los cultivos de vivero y los camotes sería un cambio radical», dijo Ranney.
Ranney y Liu han recibido una subvención del Programa de Cultivos de Frutas, Nueces, Caña de Azúcar y Viveros del Servicio de Investigación Agrícola del USDA para desarrollar métodos libre de OGMs para la edición de genes en cultivos de vivero.
Liu comenzó este proyecto como investigador postdoctoral en el laboratorio de Charles Neal Stewart, un ex alumno de Ciencias Hortícolas de la U. Estatal de Carolina del Norte, en la Universidad de Tennessee. La Agencia de Proyectos de Investigación Avanzada de Energía (ARPA-E), Thermo Fisher y el Centro de Ciencias BioEnergéticas (BESC) apoyaron la investigación.


